Maschinelles Lernen und Künstliche Intelligenz revolutionieren die Medikamentenentwicklung. Der Biophysiker und Chemiker John Chodera arbeitet an computergestützten Methoden, um die Entdeckung von Therapien für seltene Krebsarten zu beschleunigen.
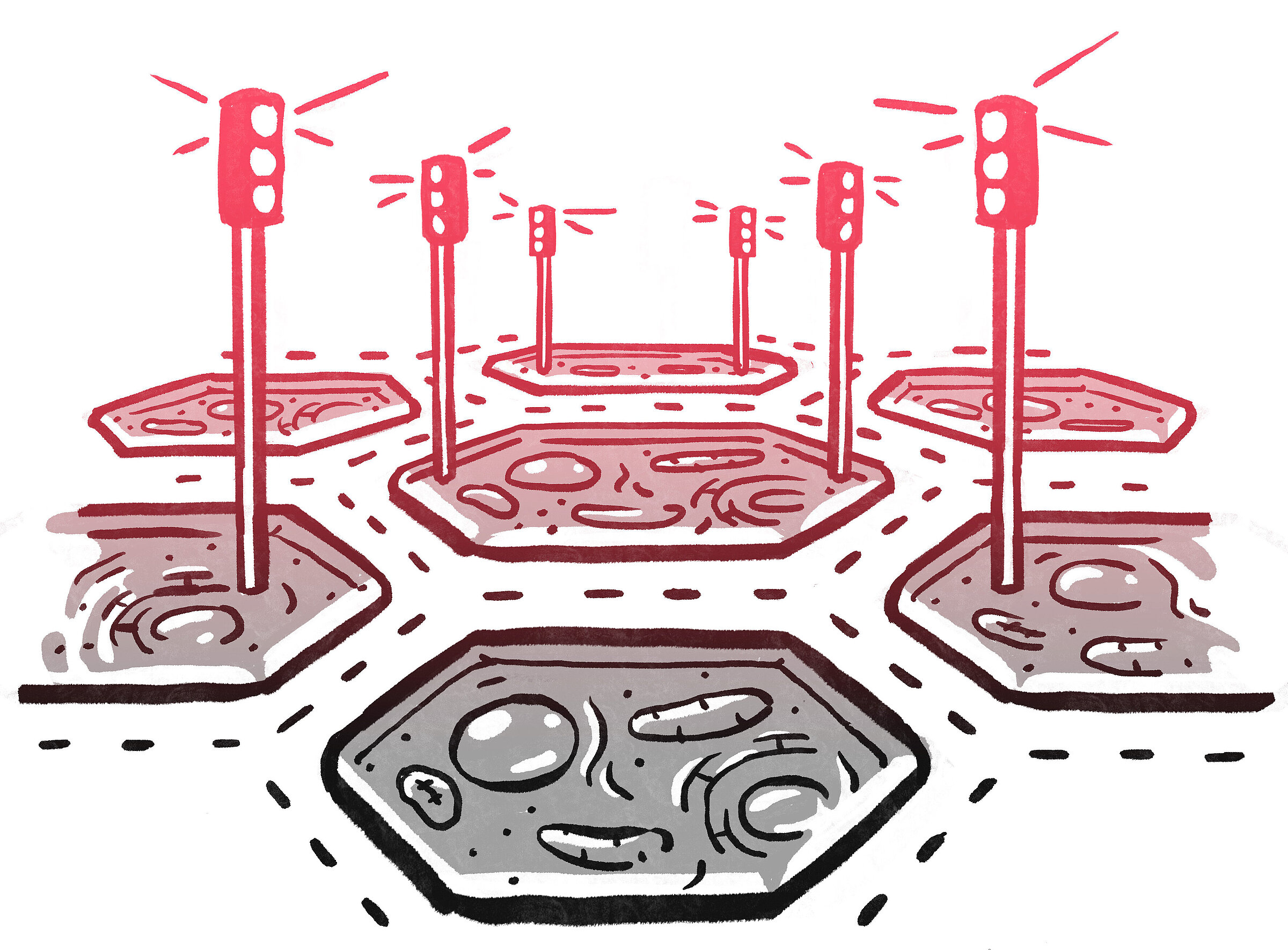
Man kann sich Kinasen wie die Ampeln einer Großstadt vorstellen, die sorgfältig aufeinander abgestimmt sind, um sicherzustellen, dass alles im Fluss bleibt. Wie mathematische Funktionen lassen diese Enzyme die Zellen im Körper entscheiden, wann es Zeit ist, sich zu teilen und zu vermehren. Wenn sie fehlgeschaltet sind, ist das so, als würde man die Ampeln an einer großen Kreuzung stören: Es kommt zu Staus, Chaos und potenziell tödlichen Unfällen – etwa dem Fortschreiten einer seltenen Krebsart wie der chronischen myeloischen Leukämie, bei der sich die weißen Blutkörperchen ungehindert vermehren.
Glücklicherweise ist es der Wissenschaft gelungen, zielgerichtete Kinasehemmer (Tyrosinkinase-Inhibitoren, TKI) zu entwickeln, die in der Lage sind, fehlgeschaltete Kinasen zu erkennen und Krebszellen, die durch sie reguliert werden, zu vernichten. Das ist bemerkenswert, denn der Mensch hat 500 Kinasen, die alle gleich aussehen. Die erste TKI-basierte Therapie wurde 2001 als eine Art Wunderwaffe für bestimmte Krebsarten zugelassen. Heute gibt es 65 zugelassene TKI-Therapien, aber sie wirken nur gegen eine sehr kleine Anzahl von Krebsarten. Bei vielen Mutationen haben wir noch nicht genügend Daten, um zu verstehen, welche Therapien am wirksamsten sind.
In meinem Einstein-Projekt arbeite ich mit Andrea Volkamer von der Charité zusammen, um die Entwicklung von Medikamenten für seltene Krebsarten zu beschleunigen. Wir arbeiten an einem integrierten System für maschinelles Lernen und physikalische Modellierung, das die potenziellen Bindungsmodi von Kinasen und Kinasemutanten berechnen kann, um nützliche Moleküle für die Entwicklung neuer TKI zu entdecken. Diese optimierten Kinasehemmer schaden den übrigen Zellen im Körper nicht und sind weniger anfällig für Resistenzbildung.
Unsere Open-Source-Plattform wird spezifische Mutationen von Patient:innen, die neuerdings durch Genomsequenzierung identifiziert werden können, nutzen, um eine die Entwicklung effektiver Kinasehemmer zu ermöglichen oder bereits zugelassene zu bewerten. Dieser computergestützte Ansatz ist dem menschlichen weit überlegen. Unsere Modelle können Entscheidungen über die Optimierung therapeutischer Moleküle für alle 500 existierenden menschlichen Kinasen viel effektiver treffen als Menschen.
Durch Maschinelles Lernen können wir die fehlgeschalteten Ampeln im Körper viel schneller erkennen und ein Einsatzteam entsenden
Solche Modelle auf der Grundlage aller in einem medizinischen Bereich gewonnenen Daten werden künftig äußerst wichtig werden, um dringend benötigte Therapien für den Menschen schneller bereitstellen zu können – sei es für Krebs, virale Pandemien oder antimikrobielle Resistenzen.
In Zukunft wird kein Mensch mehr darüber entscheiden, welche molekularen Verbindungen synthetisiert werden müssen. Das wäre so, als würde man defekte Ampeln in einer Großstadt zu Fuß suchen. Computergestützte Systeme, maschinelles Lernen und Künstliche Intelligenz ermöglichen uns eine Vogelperspektive, in der die fehlgeschalteten Ampeln automatisch erkannt werden. So können wir entscheiden, wohin wir am besten ein schnelles Einsatzteam entsenden. Bald werden wir eine vollständige Integration computergestützter Methoden in den gesamten Prozess der Medikamentenentdeckung sehen. Es geht um nichts weniger, als Medikamente auf ganz neue Weise zu entwickeln, sie effizienter bereitzustellen, sie auf Patient:innen individuell abzustimmen und zu den richtigen Organen zu befördern. Das ist es, was mich wirklich antreibt: herauszufinden, wie wir die unsere neuen Methoden nutzen können, um Therapien zu den Menschen zu bringen, die alles verändern.
Aufgezeichnet von Mirco Lomoth

