Wenn ein akuter Schlaganfall unbehandelt bleibt, sterben Hunderte Millionen von Gehirnzellen ab, weil der Blutfluss und damit ihre Versorgung unterbrochen wird. Alastair Buchan will verstehen, was mit den Zellen am Rande des Schlaganfallkerns geschieht – und neue Wege finden, sie aus dem Halbschatten wieder ans Licht zu bringen.
Schlaganfall ist in den letzten Jahren zu einer behandelbaren Krankheit geworden. Mit der Thrombolyse – einer Methode, die Blutgerinnsel in Arterien auflöst und den Blutfluss wiederherstellt – sind wir sehr erfolgreich. Noch besser funktioniert mittlerweile die Thrombektomie, das Herausziehen des Gerinnsels.
Mitte der 1980er Jahre war ich in New York an der Behandlung der ersten Schlaganfallpatient:innen mit Medikamenten beteiligt, die Gerinnsel auflösen konnten. Wir sahen, wie sie sich trotz verstopfter Hirnarterien wieder erholten, nachdem wir den Blutfluss wiederhergestellt hatten. Das war eine völlig neue Beobachtung. Die Möglichkeit, das Gehirn nach einem Schlaganfall wieder in Gang zu setzen, war eine Revolution – vergleichbar mit der Reanimation des Herzens. Zum ersten Mal konnten wir zeigen, dass Hirngewebe bei schnellem Eingreifen überleben kann.
Um 1995 wussten wir: Wenn man Menschen innerhalb von drei Stunden nach Auftreten der Symptome behandelt, sind die Auswirkungen positiv, innerhalb von zwei Stunden ist das Ergebnis doppelt so gut und eine sofortige Behandlung ist optimal. 25 Jahre später versuchen wir noch immer, gegen diese Stoppuhr anzukämpfen. „Zeit ist Gehirn“, sagen wir. Denn in jeder Minute Verzögerung werden zwei Millionen Neuronen, 14 Milliarden Synapsen und 12 Kilometer myelinisierte Nervenfasern zerstört.
Ich bin ein Kliniker: Es hat mir immer sehr viel Spaß gemacht, Patient:innen zu betreuen und das Wunder der Genesung zu erleben. Die Arbeit im Labor ist jedoch eine größere Herausforderung. Über viele Jahre hinweg haben wir versucht, die Wiederherstellung des Blutflusses – die Reperfusion – mit Medikamenten zu kombinieren, die die Gehirnzellen länger am Leben erhalten und ihre Genesung wahrscheinlicher machen. Wir haben grundlegende Mechanismen des Zelltods entdeckt. Doch trotz vielversprechender Ansätze und einer hohen Qualität der Grundlagenforschung ist es uns nicht gelungen, eine Behandlung in die klinische Praxis zu überführen, mit der Hirnzellen geschützt werden.
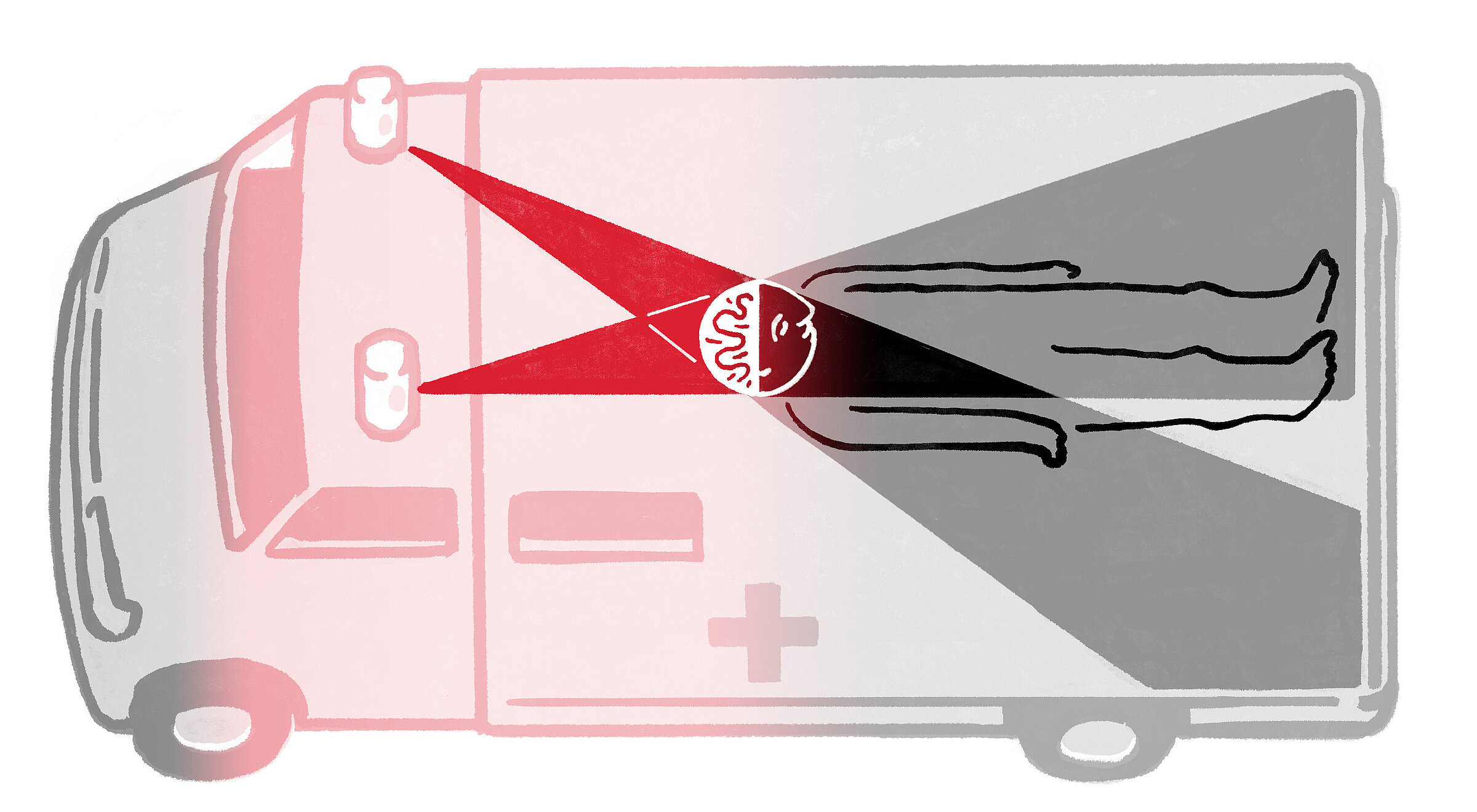
In meinem Projekt in Berlin geht es um die Untersuchung von Gewebe, das bei einem Schlaganfall zwar nicht zwangsläufig abstirbt, aber stark gefährdet ist. Wir nennen diesen Bereich Penumbra, Halbschatten. Es handelt sich um eine Art Niemandsland zwischen dem Kern der Ischämie – wo der Blutfluss unterbrochen ist – und dem umliegenden Bereich, der sich durch Reperfusion voraussichtlich regenerieren wird. Wir wollen dafür sorgen, dass diese Zone des Halbschattens sich erholt, also ins Licht statt in die Dunkelheit wandert.
Bei einer Person, die mit einem Schlaganfall der linken mittleren Hirnarterie eingeliefert wird, die nicht sprechen und auf der rechten Seite nicht sehen kann oder die rechte Seite des Gesichts, Arme oder Beine nicht spürt, können all diese Funktionen innerhalb der Halbschattenzone liegen. Bei rechtzeitiger Reperfusion kann sie zu 100 Prozent genesen.
Letztlich könnte die Wiederbelebung von Zellen in der Penumbra, im Halbschatten, auch die Art und Weise verändern, wie wir den Tod selbst definieren
Ich möchte verstehen, was in dieser Zone während der entscheidenden ein bis drei Stunden genau passiert. Wie können wir die Chancen maximieren, dass sich Zellen erholen, wieder vernetzen, erneut mit Energie versorgen und ihr Verhalten wiederaufnehmen? Dafür verbessern wir bildgebende Verfahren, um verschiedene Zelltypen und Mechanismen in Echtzeit während eines Schlaganfalls zu überwachen – sowohl in Zellkulturen und Organoiden als auch im lebenden Gehirn. Wir beobachten die Auswirkung von Medikamenten oder „neuroprotektiven“ Strategien, etwa der Verlangsamung des Stoffwechsels oder der Senkung der Körpertemperatur.
Diese „hypothermische Neuroprotektion“ ist sehr wirksam. Das ist vielleicht ein Grund dafür, warum wir eher nachts und mit dem Kopf voran geboren werden: Der Kopf kühlt schnell ab, der Glukosespiegel ist niedrig und es gibt weniger Entzündungsreaktionen. Wir versuchen, uns solche evolutionären Anpassungen zunutze zu machen. Wenn es uns gelingt, die Halbschattenzone zu verstehen und ins Licht zu holen, könnte dies ermöglichen, Zellen auch bei anderen neurodegenerativen Krankheiten wie Alzheimer oder der Motoneuron-Krankheit zu retten.
Ich beschäftige mich gerne auch mit den philosophischen Fragen der Biologie. Wofür hat die Evolution den Mechanismus des Zelltods ursprünglich erfunden? Und was können wir daraus lernen? Letztlich könnte die Wiederbelebung von Zellen in der Penumbra auch die Art und Weise verändern, wie wir den Tod selbst definieren.
Aufgezeichnet von Mirco Lomoth

